Masteroppgave om porfyrisykdom
Økt kunnskap om sykdomsmekanismen ved AIP
Marthe Christie Sæter har i sin masteroppgave i biomedisin studert enzymet HMBS og hvordan ulike varianter av enzymet påvirker funksjonen. Et HMBS-enzym som fungerer dårlig kan gi sykdommen akutt intermitterende porfyri (AIP). Oppgaven hennes bidrar med en ny brikke i forståelsen av AIP.
Publisert 07.02.2023
Sist oppdatert 31.07.2024

For å forstå AIP, må vi forstå forandringene som oppstår
Enzymer er små maskiner med helt spesifikke oppgaver i cellene våre. Noen ganger kan det oppstå genfeil som gir en liten forandring i oppskriften på enzymene, og som gjør det blir laget en variant av enzymet som er litt ulik den originale «friske» enzymvarianten. En slik variant kan fungere litt dårligere og i noen tilfeller forårsake sykdom. Vi kjenner til mange varianter av HMBS-enzymet som kan gi porfyrisykdommen AIP.
For å forstå AIP bedre, trenger vi mer kunnskap om de ulike variantene av HMBS-enzymet. Marthe Christie Sæter har i sin mastergrad i biomedisin ved Universitetet i Bergen laget og studert mange av de ulike enzymvariantene som vi vet at personer med AIP har, og sett på fasongen og hvordan de virker sammenliknet med det friske HMBS-enzymet.
Hva er HMBS?
Vi har tusenvis av enzymer i kroppen, og de har alle viktige oppgaver. HMBS er et av flere enzymer som er nødvendig for å få dannet stoffet hem. Hem er mest kjent som byggestein i hemoglobinet i blodet og er det stoffet som gjør blodet vårt rødt. I tillegg har hem viktige funksjoner i leveren. Personer som har eller er disponert for AIP har et HMBS-enzym som fungerer litt dårligere enn HMBS-enzymet som friske har.
Hvordan virker HMBS-enzymet?
HMBS-enzymet sin oppgave er å koble sammen flere av porfyrinforstadiene PBG, som illustrert i figuren under. Når det er seks PBG på snoren, klippes snoren, og det ferdige produktet sendes videre til bearbeiding av andre enzymer, og blir til slutt hem.
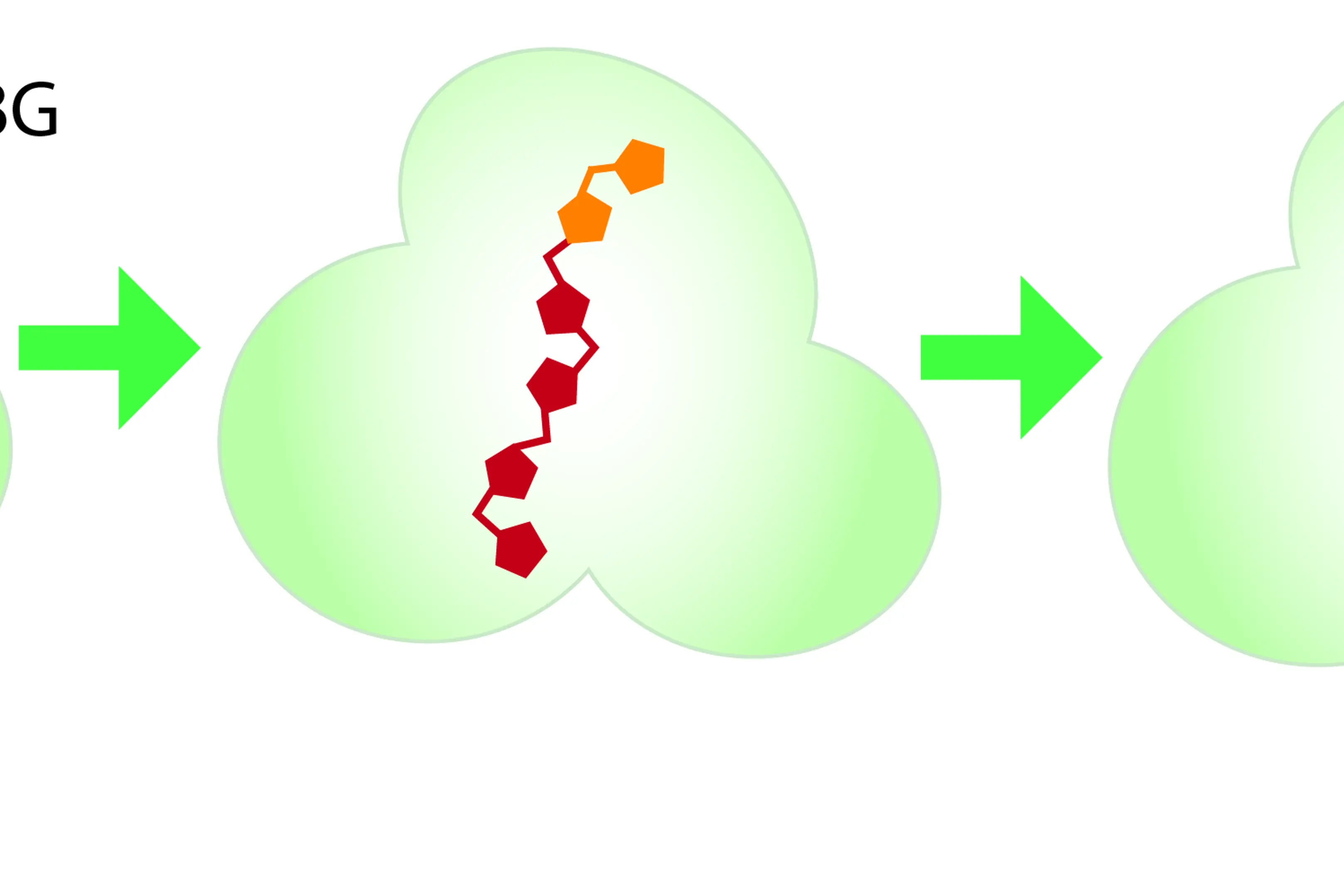
Illustrasjon på hvordan HMBS-enzymet binder sammen fire PBG-molekyler og frigjør disse til neste enzym.
Når det ikke virker helt som det skal
Et HMBS-enzym som ikke fungerer helt som det skal, kan gjøre at enzymet jobber veldig sakte eller at PBG ikke kobles sammen slik det skal. Spesielt når produksjon av hem i lever øker, kan et HMBS-enzym som jobber for sakte bli et problem slik at PBG hoper seg opp. Hos noen som er disponert for AIP vil dette kunne forårsake et akutt anfall. Opphopningen av PBG kan vi måle i en urinprøve.
Vil du vite mer om dette kan du lese en tidligere nyhetssak der forsker Helene J. Bustad forteller om sin forskning på HMBS: Forskning på årsaken til AIP
Funnene bidrar i PredPor-studien
Marthe Christie Sæther er nå ansatt på NAPOS med midler fra Nasjonal kompetansetjeneste for sjeldne diagnoser og jobber videre med å kartlegge på detaljnivå hva som skjer når HMBS ikke virker som det skal. Dette arbeidet er en del av PredPor-studien, og resultatene skal i neste omgang ses på sammen med pasientdata. Målet er å sammenligne hvordan de ulike variantene av HMBS oppfører seg, og om forskjellige varianter påvirker hvordan sykdommen arter seg.
Tittelen på Marthe sin masteroppgave er Biochemical and biophysical characterisation of HMBS variants associated with acute intermittent porphyria. Helene J. Bustad (NAPOS) og Juha P. Kallio (Universitetet i Bergen) har vært hovedveiledere, med Professor Aurora Martinez (Universitetet i Bergen) som biveileder. Noen av resultatene fra oppgaven ble nylig publisert i en forskningsartikkel i FEBS Open Bio.